- Todos
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- Ñ
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
A
Análisis de secuencias - Sequence analysis (sinónimo: secuenciación génica, secuenciación)
Proceso mediante el cual se determina la secuencia de nucleótidos en un segmento de ADN.
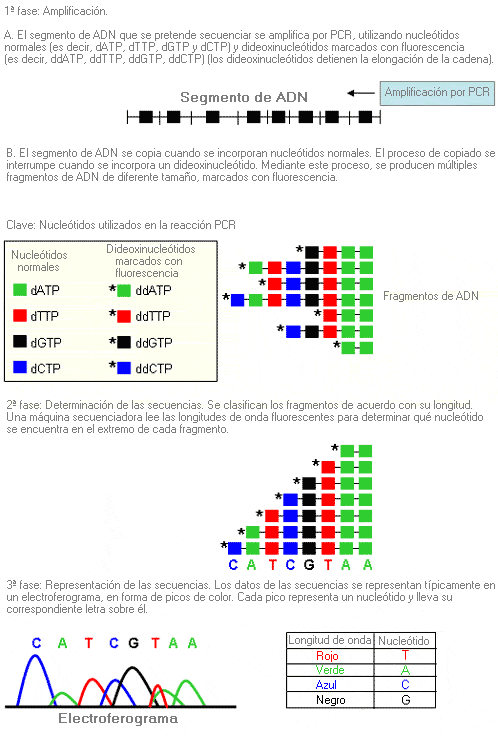
Se puede secuenciar un gen completo, pero la mayoría de las veces se secuencian sólo regiones específicas del gen que muy probablemente contendrán mutaciones (p. ej. los exones y los límites entre los intrones y los exones).
Al secuenciar un segmento de ADN, se identifican la mayoría de las variaciones producidas con respecto a la secuencia normal (por el contrario, el análisis mutacional identifica sólo mutaciones específicas en un segmento determinado de ADN).
Tipos de alteraciones de las secuencias que se pueden detectar:
Alteraciones de secuencia descritas en la literatura como patógenas
Alteraciones de secuencias previsiblemente patógenas, pero no descritas en la literatura
Alteraciones de secuencias de significación clínica imprevisible
Alteraciones de secuencias previsiblemente benignas, pero no descritas en la literatura
Alteraciones de secuencias benignas descritas en la literatura
Posibilidades en caso de que no se detecten alteraciones de las secuencias:
El paciente no presenta una mutación en el gen analizado (p. ej. hay una alteración de la secuencia en otro gen, en un locus diferente)
El paciente presenta una alteración de la secuencia que no se puede detectar mediante el análisis de secuencias (p. ej. deleción de tamaño grande)
El paciente presenta una alteración de la secuencia en una región del gen (p. ej. una región intrónica o reguladora) que no se ha detectado en el análisis de laboratorio
1Adaptado de ACGM Recommendations for Standards for Interpretation of Sequence Variations (2000)
Análisis directo del ADN - Direct DNA analysis
La utilización de técnicas de secuenciación, análisis mutacional, rastreo de mutaciones o cualquier otro medio de estudio molecular genético, para detectar variantes en un gen que pueden estar asociadas a trastornos genéticos específicos. El análisis directo del adn es posible sólo cuando se conoce el gen o genes o la región genómica, asociados con la enfermedad.
Las técnicas utilizadas para el análisis de ADN directo pueden ser las siguientes:
Análisis de secuencias
Rastreo de mutaciones (p. ej. CSGE, DHPLC, SSCP)
Análisis mutacional (p. ej. PCR, Southern blot, análisis de repeticiones de trinucleótidos, FISH, análisis de truncación de proteínas (PTT), estudios de heterocigosidad, análisis RFLP, ASO)
El análisis de ADN directo contrasta con el análisis de ligamiento (que anteriormente se denominaba análisis de ADN indirecto)
Algunas implicaciones clínicas
El análisis de ADN directo sólo es posible cuando se conoce el gen (genes) o la región genómica asociados con una enfermedad
El análisis de ligamiento se puede realizar cuando no se conoce el gen o los genes asociados con una enfermedad
Análisis mutacional específico - Targeted mutation analysis (sinónimo: análisis mutacional dirigido)
Pruebas para detectar la presencia de una mutación específica (p. ej. Glu6Val en la Anemia de Células Falciformes), un tipo de mutación específica (p. ej. la expansión de trinucleótidos repetidos asociada a la Ataxia Espinocerebelosa tipo 1, deleciones asociadas a la Distrofia Muscular de Duchenne) o un conjunto de mutaciones (p. ej. un grupo de mutaciones en la Fibrosis Quística). Difiere de la secuenciación génica completa o el rastreo de mutaciones, en que éstos detectan la mayoría de las mutaciones en la región investigada.
El análisis mutacional se utiliza en las dos situaciones siguientes:
I. Estudio de enfermedades en las que:
La mayoría o todos los individuos afectados presentan la misma mutación (p. ej. Anemia de Células Falciformes).
La mayoría o todos los individuos afectados presentan el mismo tipo de mutación (p. ej. expansión de repeticiones de trinucleótidos).
Un grupo de mutaciones son las más comunes y explican un elevado porcentaje de los casos (véase Tabla).

II. Estudio de los miembros a riesgo de una familia tras haber identificado la mutación patológica específica de la familia en un pariente afectado. Por ejemplo, si en el análisis de la secuencia se identifica una mutación patológica en un miembro afectado de la familia, todos los familiares a riesgo deben ser sometidos sólo a un análisis mutacional dirigido a detectar esa mutación específica de la familia.
Algunas implicaciones clínicas
El análisis mutacional no es generalmente el primer estudio de genética molecular que se utiliza para la identificación de mutaciones en enfermedades que se sabe están asociadas con una proporción alta de mutaciones raras (por ejemplo, específicas de una familia).
Si en un individuo afectado no se puede detectar una mutación en el análisis mutacional, puede que sea necesario realizar un análisis de la secuencia o un rastreo de otras mutaciones para identificarla.