- Todos
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- Ñ
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
A
B
C
D
E
F
FISH - Fluorescent in situ hybridization (sinónimo: hibridación in situ con fluorescencia)
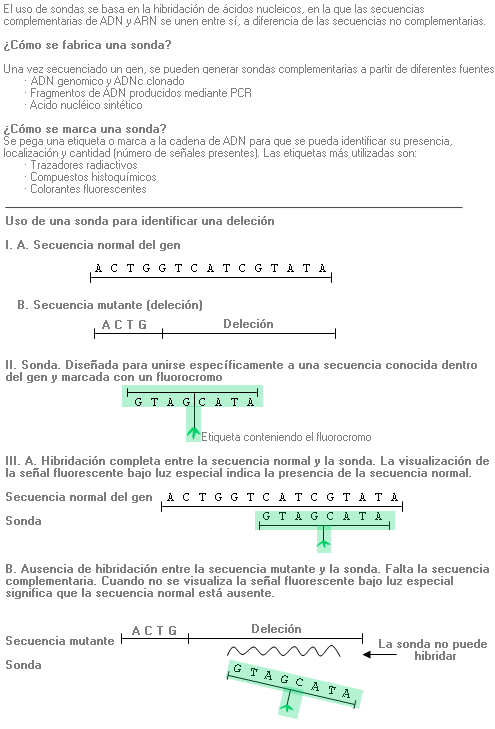
Técnica que se utiliza para identificar, en una muestra problema, la presencia de cromosomas determinados o regiones específicas de cromosomas cuya secuencia es conocida, (sondas de ADN), y que marcamos con fluorescencia. La detección se realiza tras la hibridación (reconocimiento de la secuencia y emparejamiento base a base) de la Sonda de ADN marcada sobre el ADN cromosómico desnaturalizado de la muestra problema.
1ª fase. Preparación de la sonda. Una sonda es un segmento de ADN marcado con fluorescencia que es complementario a la región cromosómica de interés.
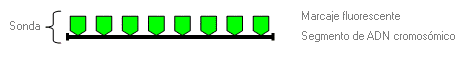
2ª fase. Hibridación. Los cromosomas desnaturalizados, fijados en el portaobjetos del microscopio, son expuestos a la sonda marcada con fluorescencia. La hibridación (fusión) tiene lugar entre la sonda y el ADN cromosómico complementario (es decir, se acopla).
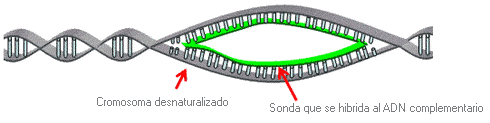
3ª fase. Visualización. Tras la hibridación, se examina el portaobjetos al microscopio con luz fluorescente. Las señales fluorescentes indican la presencia de ADN cromosómico complementario, la ausencia de tales señales implica que no hay ADN cromosómico complementario.
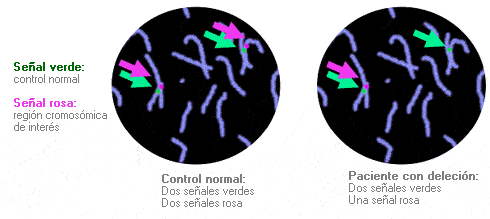
FISH en interfase - Interphasic FISH
Técnica que se utiliza para identificar, en una muestra problema, la presencia de cromosomas determinados o regiones específicas de cromosomas cuya secuencia es conocida, (sondas de ADN), y que marcamos con fluorescencia. La detección se realiza tras la hibridación (reconocimiento de la secuencia y emparejamiento base a base) de la sonda de ADN marcada sobre el ADN cromosómico desnaturalizado de la muestra problema. En la FISH en interfase, las sondas se introducen en el núcleo interfásico. La FISH en interfase se utiliza, por ejemplo para detectar tipos específicos de aneuploidía en células fetales, así como determinadas deleciones, duplicaciones y otras anomalías en células tumorales. Al contrario que la FISH en metafase, la FISH en interfase no permite visualizar los cromosomas individualizados; por lo tanto, no se podrán detectar determinados reordenamientos estructurales.
FISH en metafase - Metaphase FISH
Técnica que se utiliza para identificar, en una muestra problema, la presencia de cromosomas determinados o regiones específicas de cromosomas cuya secuencia es conocida, (sondas de ADN, y que marcamos con fluorescencia). La detección se realiza tras la hibridación (reconocimiento de la secuencia y emparejamiento base a base) de la sonda de ADN marcada sobre el ADN cromosómico desnaturalizado de la muestra problema. En la FISH en metafase, se utiliza como muestra cromosomas obtenidos a partir de células en mitosis. La división celular tiene varias fases y en la fase denominada metafase, los cromosomas se condensan y se pueden distinguir de forma individual. Al contrario que la FISH en interfase, la FISH en metafase permite visualizar la hibridación de las sondas de ADN marcado sobre cromosomas individualizados, lo que facilita la localización de la anomalía en el cromosoma específico en el que se produce.
FISH subtelomérica - Subtelomeric FISH
Técnica en la que se utilizan sondas de ADN específicas para las áreas subteloméricas de los brazos largos y cortos de cada cromosoma, que permite la detección de deleciones y translocaciones subteloméricas crípticas y submicroscópicas, que pueden ser causa de retraso mental.
G
H
Hibridación in situ con fluorescencia - Fluorescent in situ hybridization
Véase FISH
I
J
K
L
M
N
Ñ
O
P
Q
R
Región subtelomérica - Subtelomeric region
Región cromosómica más cercana al telómero (cada uno de los extremos del romosoma) que está compuesta por secuencias repetitivas de ADN muy polimórficas, situadas típicamente en las proximidades de las áreas ricas en genes. Las microdeleciones y las reordenamientos sutiles que alteran los genes en las regiones subteloméricas pueden causar retraso mental; para detectar estas anomalías normalmente es necesario utilizar hibridación fluorescente in situ (FISH) o arrays de CGH, que permiten una evaluación más detallada de las regiones subteloméricas.
S
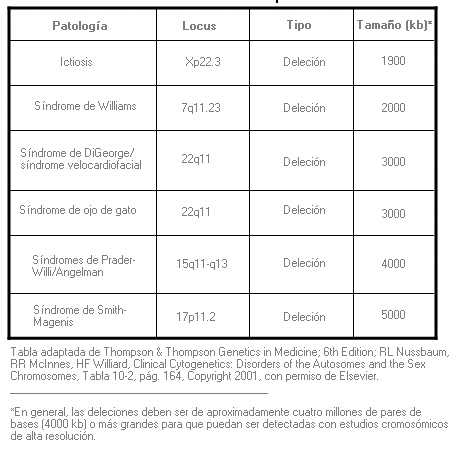
Síndrome de genes contiguos - Contiguous gene syndrome
Síndrome de microdeleción - Microdeletion syndrome (sinónimo: síndrome de deleción de genes contiguos)
Síndrome causado por una deleción cromosómica que comprende varios genes y es demasiado pequeña para poder ser detectada al microscopio utilizando métodos citogenéticos convencionales. Dependiendo del tamaño de la deleción, se pueden utilizar ocasionalmente otras técnicas, tales como FISH u otros métodos de análisis de ADN, para su identificación.
T
Translocación críptica - Cryptic chromosome translocation
Translocación o reordenamiento cromosómico que requiere técnicas especiales (p. ej. hibridación fluorescente in situ [FISH], detección telomérica) para su detección, dado que es demasiado pequeña para ser identificada con técnicas citogenéticas convencionales.